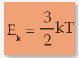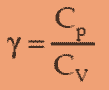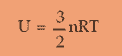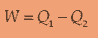Cara dan Solusi RANGKUMAN MATERI DAN CONTOH SOAL TEORI KINETIK GAS DAN TERMODINAMIKA
TEORI KINETIK GAS dan TERMODINAMIKA
V = volume
T = suhu mutlak dalam satuan kelvin
n = mol
n = m/mr
CONTOH SOAL
Gas dalam ruang tertutup bervolume 20 kilo liter dan suhu 27 C dengan tekanan 10 atm. hitung banyak mol gas dalam ruang tersebut!
Diketahui : V = 20.000 liter
t = 27º C = 27 + 273 = 300 K
P = 10 atm
Simbol R selanjutnya disebut konstanta gas umum yang nilainya 8,31 J/mol K atau 0,082 L atm/mol K.
Keterangan:
P : tekanan gas (Nm–2)
N : jumlah molekul
v : kecepatan (m/s)
m : massa molekul (kg)
V : volume gas (m3)
Ek : energi kinetik (J)
CONTOH SOAL
20 mol gas ideal dalam tabung tertutup yang bervolume 10 liter dan tekanan 2 atm. Jika jumlah molekul gas dalam tabung tersebut 10 × 1021, maka besar energi kinetik total gas dalam tabung adalah?
Diketahui : V = 10 liter
N = 10 × 1021 partikel
P = 2 atm
n = 20 mol

v = kecepatan (m/s)
Contoh soal :
Pada sebuah tangki yang bervolume 20 liter terdapat suatu gas yang bermassa 5,32 × 10-26 kg. Saat suhunya 27º C , tekanan gas tersebut sebesar 10 atm. Tentukan kecepatan efektif gas tersebut!
Diketahui : V = 20 liter
T = 27º C = 300 K
P = 10 atm
m = 5,32 × 10-26 kg
Contoh soal :
Suatu gas ideal dalam ruang tertutup yang suhunya 27° C memiliki energi kinetik partikel sebesar 150 J. Jika energi kinetiknya 300 J, maka tentukanlah suhu gas sekarang!
Diketahui : T1 = 27° C = 27 + 273 = 300 K
Ek1= 150 J , Ek2= 300 J
Ditanyakan: T2 = .... ?


Usaha Luar (W) dan Energi Dalam (U)
Sumber http://fisikasekolahmadrasah.blogspot.com

TERMODINAMIKA
PROSES – PROSES TERMODINAMIKA :
a. Proses Isobarik
Proses isobarik adalah proses yang dialami oleh gas di mana gas tidak mengalami

W = Usaha
b. Proses Isokhorik
Proses isokhorik adalah proses gas tanpa mengalami perubahan volume / volume tetap ( ΔV = 0). sehingga, usaha yang dilakukan gas pada proses isokorik bernilai nol (W = P × 0 = 0).


Usaha Luar (W) dan Energi Dalam (U)
Contoh soal :
Diketahui : P1 = 1,5 × 10^5 N/m²
T1 = 27 + 273 = 300 K
V1 = 12 liter = 1,2 × 10 m³
T2 = 127 + 273 = 400 K
P2 = P1 (isobarik)
Ditanyakan: a. V2 = ... ?
keterangan:
U = energi dalam
untuk rumus energi dalam pada gas diatomik menggunakan rumus yang sama pada gas diatomik, pada suhu rendah (dibawah suhu kamar) rumusnya sama persis dengan gas monoatomik
U =3/2 n RT
untuk suhu kamar
U = 5/2 nRT
CONTOH SOAL
Suatu gas yang berada dalam ruang yang fleksibel memiliki tekanan 1,5 × 10^5 Pa, suhu 27º C, dan volume 12 liter. Ketika gas menyerap kalor suhunya menjadi 127º C. Hitunglah energi gas mula-mula, volume gas sekarang, energi dalam sistem gas sekarang!
Diketahui : P1 = 1,5 × 10^5 Pa T1 = 27 + 273 = 300 K
V1 = 12 liter = 1,2 × 10^5 m³ T2 = 127 + 273= 400 K
Ditanyakan: a. U1 = ...?
b. V2 = ...?
Hukum I Termodinamika
Q = kalor
Q bernilai positif jika sistem menerima kalor dan sebaliknya bernilai negatif jika membuang kalor
W = usaha
W dapat bernilai positif dan negatif:
saat sistem melakukan kerja w positif dan sebaliknya bernilai negatif jika dikenai usaha
saat sistem melakukan kerja w positif dan sebaliknya bernilai negatif jika dikenai usaha
CONTOH SOAL
gas monoatomik pada suhu 27º C dengan tekanan sebesar 1,5 × 10^5 Pa dan bervolume 15 liter. Sistem mengambil kalor dari lingkungan dengan cara isobarik sehingga suhu naik menjadi 127 C. Tentukan:
a. volume gas sekarang,
b. usaha luar yang dilakukan gas,
c. penambahan energi dalam gas, dan
d. besarnya kalor yang diserap gas!
a. volume gas sekarang,
b. usaha luar yang dilakukan gas,
c. penambahan energi dalam gas, dan
d. besarnya kalor yang diserap gas!
Diketahui : T1 = 27 + 273 = 300 K
P1 = 1,5 × 10^5 N/m²
V1 = 15 liter = 15 × 10^-2 m³
T2 = 127 + 273= 400 K
Ditanyakan: a. V2 = ...?
b. W = ...?
c. Δ U= ...?
d. Q = ...?
Entropi
Entropi adalah ukuran banyaknya energi atau kalor yang tidak dapat diubah menjadi usaha.
Mesin Pendingin
Keterangan
Kp : koefisien daya guna
Q1 : kalor yang diberikan pada reservoir suhu tinggi (J)
Q2 : kalor yang diserap pada reservoir suhu rendah (J)
W : usaha yang diperlukan (J)
T1 : suhu reservoir suhu tinggi (K)
T2 : suhu reservoir suhu rendah (K)
Mesin Carnot
Keterangan:
η : efisiensi mesin Carnot
T1 : suhu reservoir bersuhu tinggi (K)
T2 : suhu reservoir bersuhu rendah (K)
Q1 = kalor yang diserap
Q2 = kalor yang dibuang
CONTOH SOAL
Sebuah mesin Carnot menyerap kalor sebesar 1.000 kJ. Mesin bekerja pada reservoir bersuhu tinggi 300 K dan bersuhu rendah100 K. Berapa kalor yang terbuang oleh mesin?
T2 = 200 K
Q1 = 1.000 kJ
Ditanyakan: Q2 = ...?
Jawab :

untuk soal latihan dan pembahasan lengkap tentang teori kinetik gas dan termodinamika.
>> BACA: teori kinetik gas dan termodinamika (soal dan pembahasan)

untuk soal latihan dan pembahasan lengkap tentang teori kinetik gas dan termodinamika.
>> BACA: teori kinetik gas dan termodinamika (soal dan pembahasan)